La migraine, une maladie complexe
Chaque jour, des millions de personnes ressentent une douleur lancinante, sourde ou intense, qui frappe un côté de la tête ou les deux. Ce n’est pas un simple mal de tête : c’est une crise migraineuse.
Une maladie neurologique complexe, souvent chronique, qui peut durer des heures, voire des jours, et bouleverser une vie. Lumière, bruit, odeur, tout devient insupportable.
Certains patients sont touchés dès l’enfance, d’autres voient apparaître les premiers symptômes à l’âge adulte, souvent sans comprendre leur origine.
Plusieurs types de migraines
Il existe plusieurs types de migraines, aux origines variées :
vasculaires, neuronales ou hormonales. Les douleurs peuvent s’accompagner de nausées,
de vomissements, de troubles visuels, voire parfois de paralysies
transitoires. Chaque forme a ses propres déclencheurs, une intensité
variable et une fréquence différente.

Des causes variables
Pour de nombreuses personnes, le diagnostic est tardif, les examens se multiplient, et les traitements s’enchaînent sans réel succès.
Les causes et symptômes sont nombreux, variés, parfois atypiques : les
connaître, c’est la première étape pour soulager efficacement la migraine.
Mais les recherches avancent. Grâce aux progrès sur la physiopathologie, les neuropeptides, le cortex, le tronc cérébral ou l’inflammation vasculaire, de nouveaux traitements apparaissent.
Comprendre la migraine, c’est reprendre le contrôle sur sa santé, sur son corps, sur sa vie.
Qu'est-ce que la migraine ? Définition
La migraine est une maladie neurologique chronique marquée par des crises de céphalées récurrentes, modérées à sévères, souvent ressenties d’un seul côté de la tête. Bien plus qu’un simple mal de tête, chaque crise migraineuse peut durer de 4 à 72 heures et s’aggraver avec le moindre effort physique.
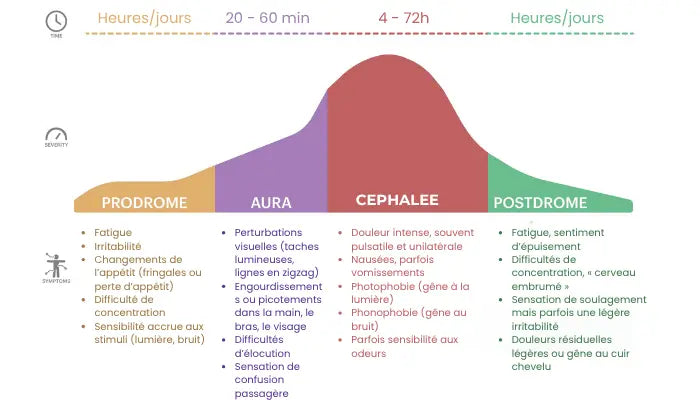
Les phases de la migraine
Ce schéma représente les 4 phases de la migraine : les prodromes, l'aura, la céphalée et les postdromes.

Conférence sur la migraine
Visionnez le replay de cette conférence animée par le Dr Shrivastava lors de la journée de la douleur.
Symptômes associés
Tableau comparatif des céphalées les plus courantes :
À retenir : la migraine est d’origine neurologique, liée à une dysfonction transitoire du cerveau, impliquant les neurones, les vaisseaux sanguins et la libération de neuropeptides comme le CGRP. Ce n’est ni une maladie vasculaire, ni simplement hormonale, ni psychologique.
Durée et type de douleur :
| Type de céphalée | Durée | Douleur |
|---|---|---|
| Migraine | 4 à 72 h | Pulsatile, souvent unilatérale |
| Céphalée de tension | 30 min à 7 jours | Sensation de serrement, bilatérale |
| Algie vasculaire de la face | 15 min à 3 h | Brûlure intense autour de l’œil |
Symptômes associés et intensité :
| Type de céphalée | Symptômes associés | Intensité |
|---|---|---|
| Migraine | Nausées, vomissements, photophobie, phonophobie | Modérée à sévère |
| Céphalée de tension | Fatigue, tension cervicale, pas de nausée | Légère à modérée |
| Algie vasculaire de la face | Larmoiement, nez bouché, agitation | Très sévère |

Une pathologie qui bouleverse la vie
La migraine est invisible, mais son retentissement est bien réel. Pour ceux qui en souffrent régulièrement, elle peut affecter toutes les dimensions de la vie quotidienne. Elle touche environ 15 % de la population mondiale, et constitue l’une des principales causes d’années vécues avec handicap selon l’OMS.
La migraine n’est donc pas une simple gêne ponctuelle, mais bien une maladie chronique, avec des mécanismes complexes et des manifestations multiples. Mieux la comprendre, c’est le premier pas vers un diagnostic plus rapide, un traitement adapté et une meilleure qualité de vie.
Conséquences courantes de la migraine sur la vie des patients
L'impact sociale de la migraine
Cette étude, menée avec l’association La Voix des Migraineux, donne la parole à 683 patients migraineux en France. Elle révèle :
- Un parcours de soins difficile : 7,5 ans en moyenne pour obtenir un diagnostic.
- Un handicap sévère : 96 % des participants ont un score HIT-6 élevé, et 70,7 % un score MIDAS indiquant une forte incapacité.
- Un impact professionnel et social majeur : 36 % décrivent leur parcours comme un "parcours du combattant", et plus de la moitié ne se sentent ni écoutés ni soutenus par les professionnels de santé.
- Un besoin criant d’amélioration du système de soins : retards de traitement, effets secondaires mal pris en charge, manque d’accès aux spécialistes.
Un plafond de verre
- Chez l’enfant : absences répétées à l’école, difficultés de concentration, anxiété
- Chez l’adulte actif : arrêts de travail fréquents, perte de productivité
- Chez les femmes : crises liées au cycle menstruel, influence hormonale marquée
- Sur le bien-être psychologique : repli sur soi, peur de la prochaine crise, incompréhension de l’entourage
- Dans la vie sociale : isolement, annulations de dernière minute, perte de spontanéité
Chaque personne migraineuse a un profil différent :
- Certaines font une crise par an, d’autres plusieurs par semaine
- La douleur peut durer 2 heures ou 3 jours
- Les symptômes associés varient : visuels, digestifs, neurologiques, etc.
Le graphique suivant montre l'évolution de la prévalence de la migraine selon l'âge.
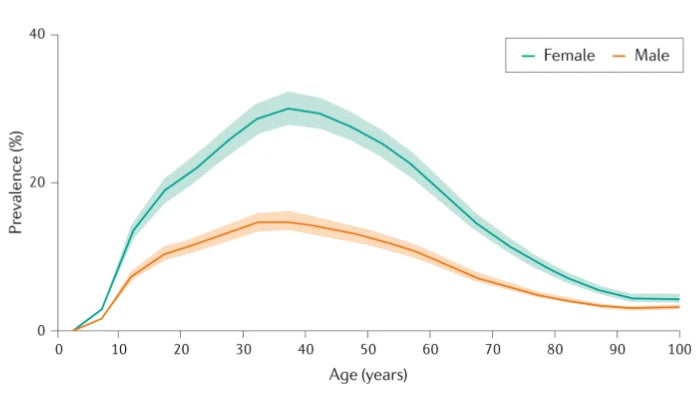
De plus en plus de patients migraineux
Cette analyse des données du Global Burden of Disease montre que :
- La prévalence mondiale de la migraine a augmenté de 58 % entre 1990 et 2021, atteignant 1,16 milliard de personnes.
- La migraine est la 2e cause mondiale de handicap (en années vécues avec une incapacité).
- Les adolescents et les hommes voient une croissance rapide de la prévalence.
- Les projections indiquent une hausse continue jusqu’en 2050, avec des implications majeures pour les politiques de santé publique.
Rejoignez la communauté ChèreMigraine
Entrez votre e-mail pour rejoindre ChèreMigraine et recevoir votre premier cadeau
Une communauté de patients migraineux
Vous souffrez de migraines ? Vous n’êtes pas seul.e.
Des milliers de patients comme vous ont déjà rejoint ChèreMigraine, la communauté dédiée à celles et ceux qui veulent mieux comprendre, mieux gérer… et mieux vivre avec leurs migraines.
En vous inscrivant avec votre e-mail, vous recevrez :
- astuces concrètes pour soulager les crises,
- conseils de spécialistes,
- cadeaux exclusifs, comme notre Cahier des Migraines
- l'actualités scientifiques sur la migraine, directement dans votre boîte mail.
Vous pouvez aussi nous retrouver sur Instagram ( @Chèremigraine ) pour échanger avec la communauté, partager vos expériences et rester informé.e au quotidien.
Identifier les différents types de migraines
La migraine n’a pas une seule et unique présentation. Derrière ce mot se cache une grande diversité de formes cliniques, avec des durées, des symptômes et des intensités très variables. Il est essentiel de comprendre que toutes les migraines ne se ressemblent pas : bien identifier le type de migraine dont on souffre est une étape clé vers un diagnostic précis et un traitement adapté.
Pour aller plus loin et découvrir davantage les différentes formes de migraine (avec ou sans aura, migraine ophtalmique, hémiplégique, etc.), explorez notre article : Les types de migraines.

Migraine sans aura
C’est la forme de migraine la plus fréquente : elle représente environ 75 % des cas.
Elle se manifeste par :
- Une douleur pulsatile, souvent localisée d’un seul côté de la tête (mais parfois bilatérale)
- Une intensité modérée à sévère
- Une durée de 4 à 72 heures
- Des symptômes associés :
nausées, vomissements,
photophobie, phonophobie...
Elle survient sans signe annonciateur évident (comme une aura), bien que certains patients puissent ressentir une phase de prodrome avant la douleur.

Migraine avec aura
La migraine avec aura concerne environ 20 à 25 % des personnes migraineuses. Elle se caractérise par l’apparition de symptômes neurologiques transitoires qui précèdent (ou accompagnent) la douleur.
Les auras peuvent être :
- Visuelles (les plus fréquentes) : points scintillants, lignes en zigzag, taches sombres ou floues
- Sensorielles : picotements, engourdissement d’un bras ou du visage
- Motrices (plus rares) : sensation de faiblesse musculaire ou troubles de la parole
Ces symptômes apparaissent progressivement en 5 à 60 minutes, durent généralement moins d’une heure, et disparaissent totalement. La céphalée peut survenir immédiatement après, ou être différée de quelques heures.

Formes rares ou atypiques
Certaines migraines présentent des manifestations inhabituelles ou concernent des populations spécifiques.
- Migraine ophtalmique : se manifeste par des troubles visuels importants
- Migraine hémiplégique : très rare, elle provoque une faiblesse temporaire d’un côté du corps, imitant un AVC.
- Migraine vestibulaire : caractérisée par des vertiges récurrents (avec ou sans douleur), troubles de l’équilibre et nausées intenses.
- Migraine abdominale : typique de l’enfant, elle provoque des douleurs abdominales intenses par crises, sans douleur à la tête.
- Migraine cataméniale : liée au cycle menstruel, elle survient dans les jours précédant les règles, souvent plus longue et résistante aux traitements habituels.

La migraine chronique
La migraine chronique est une forme sévère de migraine, définie par :
- ≥ 15 jours de céphalées par mois , dont au moins 8 jours avec critères de migraine
- Une durée supérieure à 3 mois
- Un impact majeur sur la qualité de vie, la productivité et le moral
- Une association fréquente à des comorbidités : anxiété, dépression, troubles du sommeil
- Un risque accru d’abus médicamenteux et de passage en migraine réfractaire
Elle nécessite une prise en charge médicale spécialisée, avec des traitements de fond adaptés et un suivi régulier pour espérer réduire la fréquence des crises.
Données épidémiologiques
La migraine est l’une des affections neurologiques les plus répandues, bien plus qu’on ne le pense. Selon l’Organisation mondiale de la santé (OMS), elle touche environ 1 personne sur 7 dans le monde, soit près de 1 milliard d’individus. Ce chiffre impressionnant place la migraine au même rang que d'autres grandes maladies chroniques comme le diabète ou l'asthme mais avec une reconnaissance publique et médicale encore largement insuffisante.
Elle ne se limite pas à un continent ou à une culture. La migraine concerne tous les groupes ethniques, tous les niveaux socio-économiques, et elle est présente dans toutes les zones géographiques. Bien que les conditions de diagnostic et de prise en charge varient selon les pays, le fardeau de la maladie reste global.
Poids socio-économique
La migraine est non seulement fréquente, mais elle est aussi l’une des principales causes de perte de qualité de vie dans le monde. Selon l’étude Global Burden of Disease publiée dans The Lancet, la migraine représente la 2e cause mondiale d’années vécues avec un handicap (YLD) chez les moins de 50 ans, toutes maladies confondues.
Ce retentissement fonctionnel massif s’explique par :
- La fréquence des crises, souvent imprévisibles, qui empêchent toute planification d'activité
- La sévérité des symptômes : douleurs, troubles sensoriels, nausées invalidantes
- L’impact sur la productivité : baisse de concentration, absentéisme répété, fatigue persistante
Ce fardeau invisible génère des coûts importants :
- Arrêts de travail fréquents dans les périodes de crise
- Dépenses de santé répétées : consultations, examens, traitements parfois inefficaces
- Errance diagnostique : patients mal orientés, explorations inutiles, retards de prise en charge
- Hospitalisations ponctuelles, notamment en cas de migraine chronique ou résistante
Et pourtant, dans de nombreux pays, la migraine reste sous-diagnostiquée, sous-traitée et sous-financée. Elle est encore trop souvent perçue comme une gêne mineure, alors qu’elle constitue une véritable maladie chronique handicapante.
Les personnes atteintes de migraine chronique (plus de 15 jours de migraine par mois) sont particulièrement exposées à une dégradation de leur qualité de vie, mais aussi à des comorbidités (anxiété, dépression, troubles du sommeil). La migraine ne s’exprime pas de la même façon chez chacun. Certains patients ne font qu’une crise par an, d’autres peuvent en avoir plusieurs par semaine. Cette variabilité complique sa reconnaissance et sa prise en charge.
Face à cette diversité de situations, il est essentiel d’adopter une approche personnalisée. Pour découvrir des solutions concrètes et des conseils pratiques au quotidien, consultez notre article dédié : Comment soulager la migraine ?
Le rôle du système nerveux central
La migraine ne naît pas dans les artères… mais bien dans le cerveau. Le cerveau migraineux devient hypersensible à des stimuli bénins (lumière, bruit, odeur), en raison d’une activation anormale de circuits neuronaux : c’est la sensibilisation centrale.
Zones impliquées dans le déclenchement et le maintien de la migraine :
Le cortex cérébral
Le cortex cérébral, en particulier dans les migraines avec aura, présente une hyperactivité soudaine suivie d’une onde de dépression électrique appelée dépression corticale envahissante. Ce phénomène entraîne des troubles visuels, sensoriels ou moteurs en fonction des zones touchées, avant même que la douleur n’apparaisse.
Le tronc cérébral
Le tronc cérébral, en particulier les noyaux du nerf trijumeau, agit comme un centre de transmission de la douleur. C’est lui qui relaie les signaux nociceptifs vers le cerveau et active une réponse inflammatoire dans les méninges, les fines membranes qui entourent le cerveau.
L’hypothalamus
L’hypothalamus est souvent activé dans les heures précédant la crise. Cette structure régule de nombreuses fonctions biologiques :
sommeil, appétit, hormones,
stress… autant de facteurs déclenchants identifiés dans la migraine. Certains patients ressentent d’ailleurs des signes avant-coureurs (envies alimentaires, irritabilité, bâillements) plusieurs heures avant la douleur : c’est la phase de prodrome, directement liée à l’hypothalamus.
Le nerf trijumeau
Le nerf trijumeau, qui innerve le visage et une grande partie du crâne, joue un rôle central dans la génération de la douleur migraineuse. Lorsqu’il est activé, il libère des substances inflammatoires dans les méninges, contribuant à l’amplification de la douleur.

Inflammation neurovasculaire et neurotransmetteurs
Le rôle des vaisseaux sanguins ne disparaît pas pour autant. Lors d’une crise, on observe une dilatation des vaisseaux méningés, c’est-à-dire les vaisseaux situés dans les membranes entourant le cerveau. Cette dilatation n’est pas la cause unique de la douleur, mais elle contribue à une
inflammation neurogénique locale.
Cette inflammation est alimentée par la libération de plusieurs
neurotransmetteurs et neuropeptides :
Le CGRP
Le CGRP (Calcitonin Gene-Related Peptide) est aujourd’hui au cœur de la recherche migraineuse. Il est libéré par les neurones du nerf trijumeau et provoque à la fois vasodilatation, inflammation
et transmission de la douleur. Les nouveaux traitements anti-CGRP ciblent directement ce mécanisme.
La sérotonine
La sérotonine (5-HT) joue un rôle ambivalent. En baisse avant la crise, elle pourrait être un déclencheur indirect. Les triptans, traitements classiques de la crise, agissent en partie sur les récepteurs à sérotonine.
La dopamine
La dopamine, impliquée dans la régulation de l’humeur, de la motivation et du système digestif, peut expliquer certains
symptômes associés à la migraine (nausées, troubles gastro-intestinaux, fatigue intense).
La substance P
La substance P et le glutamate
participent à l’entretien de l’inflammation et à l’excitation prolongée des neurones de la douleur.

Terrain génétique et hypersensibilité neuronale
Pourquoi certaines personnes sont-elles plus sujettes à la migraine que d’autres ? La réponse se trouve en partie dans les gènes. Certaines mutations ont été identifiées dans les formes familiales rares, comme la migraine hémiplégique. Ces mutations affectent le transport des ions (calcium, sodium) à travers les membranes neuronales, modifiant la réactivité des neurones.
Mais même dans les formes non héréditaires, la prédisposition familiale est très fréquente : plus de 70 % des patients migraineux ont un parent également touché.
Cette susceptibilité génétique s’exprime souvent par une hypersensibilité neuronale :
- Les stimuli sensoriels (lumière vive, bruits, odeurs) sont perçus comme agressifs
- Le cerveau réagit de façon exagérée au manque de sommeil, au stress, ou à certains aliments
- L’excitation neuronale n’est pas correctement modulée, ce qui facilite le déclenchement des crises
Ce terrain particulier explique la variabilité d’une personne à l’autre, mais aussi d’une crise à l’autre. Il souligne l’importance d’une approche personnalisée dans le diagnostic et la prise en charge.
Causes, facteurs et risques déclencheurs
La migraine ne survient pas au hasard. Si ses mécanismes neurologiques sont aujourd’hui mieux compris , ses causes profondes restent encore partiellement élucidées. On sait toutefois qu’elle résulte de facteurs multiples: génétiques, hormonaux, environnementaux et sensoriels. Ces éléments influencent à la fois la prédisposition à souffrir de migraine et la fréquence des crises.
Pour aller plus loin, découvrez notre article dédié aux causes et symptômes de la migraine, afin de mieux reconnaître les signaux du corps et comprendre les mécanismes en jeu.

Les 4 phases de la crise migraineuse
Une crise migraineuse ne commence pas et ne se termine pas avec la douleur. Elle se décompose souvent en plusieurs phases successives, qui peuvent s’étaler sur plusieurs heures, voire plusieurs jours.
Les 4 grandes phases :
Le prodrome (quelques heures à deux jours avant la crise) :
- Signes précoces : bâillements, irritabilité, fringales, difficulté à se concentrer
- Cette phase est souvent sous-estimée, mais peut aider à anticiper la crise
L’aura (chez 20 à 25 % des patients) :
- Troubles visuels (scintillements, flous, lignes en zigzag), troubles sensoriels ou moteurs
- Dure de 5 à 60 minutes, précède généralement la douleur
La phase douloureuse :
- Douleur intense, unilatérale, pulsatile
- Symptômes associés (nausées, photophobie, phonophobie...)
- Peut durer de 4 à 72 heures si non traitée
Le postdrome (phase de récupération) :
- Sensation de fatigue extrême, confusion, corps « vidé »
- Peut durer 24 à 48 heures après la disparition de la douleur
Comprendre ces phases permet de mieux anticiper les crises et d’adapter le traitement dès les premiers signes.

Quand consulter un spécialiste ?
La migraine peut souvent être diagnostiquée par un médecin généraliste, mais certaines situations nécessitent l’avis d’un neurologue ou d’un centre spécialisé dans les céphalées.
Voici quelques situations où une consultation spécialisée est recommandée :
- Douleur inhabituelle ou brutale, surtout si elle apparaît soudainement (« coup de tonnerre »)
- Aggravation rapide de la fréquence ou de l’intensité des crises
- Anomalies neurologiques inhabituelles : perte de vision, trouble de la parole, paralysie
- Échec des traitements de crise classiques ou suspicion de migraine chronique
Il est important de ne pas banaliser une migraine qui change de forme, s’intensifie, ou s’accompagne de signes atypiques. Dans certains cas, ces symptômes peuvent révéler une pathologie plus grave (AVC, tumeur, méningite), d’où l’importance de ne pas retarder le diagnostic.
À noter : une migraine stable depuis plusieurs années, avec symptômes classiques, ne nécessite pas systématiquement d’imagerie cérébrale.

L’importance du suivi
Une fois le diagnostic posé, il est essentiel de mettre en place un suivi régulier, même si les crises sont peu fréquentes. La migraine est une maladie évolutive : sa fréquence, son intensité et ses déclencheurs peuvent changer avec le temps.
Voici les éléments clés d’un bon suivi :
- Tenue d’un journal de crise : fréquence, durée, symptômes, déclencheurs, réponse au traitement
- Consultations régulières : pour ajuster le traitement, évaluer le retentissement, repérer un passage à la migraine chronique
- Évaluation du retentissement sur la qualité de vie : échelle MIDAS, HIT-6, ou questionnaires spécialisés
- Adaptation du traitement de fond en fonction de l’évolution : un traitement efficace au début peut ne plus l’être après quelques mois
Un bon suivi permet aussi d’anticiper les complications, comme la surconsommation médicamenteuse (cause fréquente de céphalée chronique) ou les comorbidités psychologiques (anxiété, dépression).

Traitements de crise et de fond
Il n’existe pas de solution universelle pour soulager la migraine : les traitements doivent être personnalisés.
Traitements de la crise
Les traitements de crise ont pour objectif de stopper la douleur le plus rapidement possible, et de limiter les symptômes associés (nausées, vomissements, photophobie…).
Médicaments utilisés :
- AINS (anti-inflammatoires non stéroïdiens)
- Triptans : médicaments spécifiques de la migraine
- Antiémétiques
Alternatives complémentaires :
- Huiles essentielles : la menthe poivrée ou la lavande vraie
- Repos dans le noir et le silence
- Techniques de relaxation
Traitements de fond
Lorsque les crises deviennent trop fréquentes (plus de 4 jours par mois) ou très invalidantes, un traitement de fond peut être proposé. Son objectif : diminuer la fréquence, l’intensité et la durée des crises, voire les faire disparaître.
Médicaments préventifs classiques :
- Bêtabloquants (propranolol, métoprolol)
- Antiépileptiques (topiramate, valproate)
- Antidépresseurs tricycliques (amitriptyline)
- Anticorps anti-CGRP (erenumab, galcanezumab, fremanezumab)
| Profil migraineux | Caractéristiques | Traitement recommandé |
|---|---|---|
| Migraine épisodique sans aura | Crises peu fréquentes, douleur unilatérale pulsatile, nausées | AINS, triptans au besoin, hygiène de vie |
| Migraine avec aura | Troubles visuels ou sensoriels avant la douleur | Triptans dès l’aura, traitement de fond si récurrence |
| Migraine cataméniale | Crises liées aux menstruations, souvent résistantes | Triptans, anti-inflammatoires, traitement hormonal ciblé |
| Migraine chronique | ≥ 15 jours de maux de tête/mois dont ≥ 8 jours de migraine | Traitement de fond (anti-CGRP, bêtabloquants, TENS) |
| Migraine résistante ou médicamenteuse | Échec des traitements classiques, abus médicamenteux | Sevrage, centre anti-douleur, alternatives non médicamenteuses |
Mieux vivre avec la migraine au quotidien
La migraine ne se soigne pas seulement par des médicaments. Elle se gère aussi au quotidien par l’observation, la prévention et l’adaptation. Comprendre sa maladie, identifier ses déclencheurs et ajuster son environnement permettent souvent de réduire la fréquence des crises et de retrouver une meilleure qualité de vie. Il ne s’agit pas simplement d’éviter ce qui fait mal, mais d’apprendre à composer avec une sensibilité neurologique particulière.
Éviter les déclencheurs
Identifier les éléments qui précèdent ou favorisent les crises est un point clé dans la gestion de la migraine. Ce n’est pas une démarche standard : chaque patient est unique.
Trois piliers à surveiller :
- Routine de sommeil : se coucher et se lever à heure fixe, éviter les variations brutales (week-ends, décalages horaires), limiter les écrans en soirée.
- Gestion du stress : relaxation, sophrologie, activité physique douce, cohérence cardiaque. Le stress est un des facteurs les plus fréquemment retrouvés avant une crise.
- Hygiène de vie globale : alimentation régulière, bonne hydratation, suppression des excès (café, sucre, alcool), pauses fréquentes en cas de travail sur écran.
Tenir un journal de crise permet de croiser les déclencheurs potentiels (nourriture, émotions, météo...) et d’identifier les profils de risque.
Adapter son environnement
L’environnement sensoriel joue un rôle majeur dans le déclenchement ou l’aggravation d’une migraine. Adapter son cadre de vie peut grandement limiter les agressions visuelles, sonores ou olfactives.
Quelques ajustements simples :
- Lumière : privilégier la lumière naturelle tamisée, utiliser des filtres pour écrans, éviter les éclairages LED trop blancs ou clignotants.
- Bruit : écouteurs avec réduction de bruit passive, zones calmes au travail ou à l’école, pauses sensorielles régulières.
- Odeurs : éviter les parfums forts, aérer régulièrement les pièces, choisir des produits d’entretien neutres.
- Poste de travail : écran à bonne hauteur, siège ergonomique, pauses oculaires toutes les 20 minutes.
Ces mesures réduisent la charge sensorielle subie par le cerveau, en particulier lors des phases prodromiques où il devient plus vulnérable.
En parler autour de soi
La migraine est souvent invisible. Pourtant, elle a des répercussions sociales, scolaires et professionnelles majeures. En parler est essentiel pour obtenir du soutien et adapter son quotidien sans culpabilité.
Pourquoi communiquer sur sa migraine ?
- En milieu professionnel : aménagements possibles (horaires flexibles, télétravail, pauses supplémentaires, poste adapté)
- En milieu scolaire : meilleure tolérance des absences, adaptation des examens ou des rythmes d’apprentissage
- Dans le cercle familial : compréhension des crises, réduction du stress relationnel, meilleure gestion des responsabilités
L’acceptation de la migraine comme une vraie pathologie neurologique est une étape importante pour le patient. Ce n’est pas une faiblesse, ni un simple mal de tête, mais une condition chronique avec un retentissement réel sur la qualité de vie .
Des associations comme La Voix des Migraineux proposent des ressources pour expliquer la migraine à ses proches, à ses collègues ou à ses enseignants.
Pour aller plus loin, explorez notre article : Comment soulager la migraine ?

Ce que la migraine révèle de notre cerveau
Et si la migraine n'était pas uniquement une pathologie à éliminer, mais également une manifestation des stratégies de régulation ? Certains neurologues proposent une lecture évolutive de la migraine. Le cerveau migraineux serait en réalité un cerveau hyper-réactif, conçu pour détecter très tôt les menaces : surcharge sensorielle, fatigue extrême, danger environnemental. La crise migraineuse serait alors une réponse de protection.
En cas de surcharge le cerveau migraineux déclencherait une crise pour interrompre brutalement l’activité neuronale excessive. Ce processus, impliquant notamment la dépression corticale envahissante ou la libération de neuropeptides comme le CGRP, serait une forme extrême de protection des circuits supérieurs.
Un modèle pour mieux comprendre la douleur chronique :
- Mieux comprendre les mécanismes de chronicisation de la douleur
- Identifier les structures cérébrales impliquées dans la modulation de la douleur
- Explorer de nouvelles cibles thérapeutiques comme les traitements anti-CGRP, la stimulation magnétique transcrânienne, ou la modulation des réseaux neuronaux impliqués dans la douleur
- Le choix d’une sélection entraîne une actualisation complète de la page.
- Ouvre dans une nouvelle fenêtre.

















